Die neue EU-Verordnung über In-vitro-Diagnostika – IVDR
Mit dem Ziel, die Patientensicherheit zu verbessern, hat die Europäische Kommission die bestehenden Medizinprodukte- und In-vitro-Diagnostika-Richtlinien überarbeitet. Die neue Verordnung über In-vitro-Diagnostika (EU) 2017/746 (In-vitro Diagnostic Medical Devices Regulation, IVDR) ist gemeinsam mit der Verordnung über Medizinprodukte am 25. Mai 2017 in Kraft getreten. Sie ersetzt die bisherige EU-Richtlinie 98/79/EG. Nach einer fünfjährigen Übergangsfrist ist die IVDR seit dem 26. Mai 2022 verpflichtend anzuwenden. Die Verordnung muss nicht in nationales Recht umgesetzt werden, sondern ist unmittelbar in den Mitgliedstaaten gültig. Dies führt innerhalb der Europäischen Union zu einer Harmonisierung der Standards für In-vitro-Diagnostika.
Sowohl neue Produkte als auch bereits auf dem Markt befindliche und zugelassene Bestandsprodukte müssen der neuen Verordnung entsprechend zertifiziert werden. Dies kann lediglich von einer Benannten Stelle durchgeführt werden, die sich bereits im Zuge eines Neubenennungsverfahrens unter der IVDR neu benannt hat. Der Prozess ist derzeit noch nicht abgeschlossen (Stand September 2023).
Die wichtigsten Änderungen auf einen Blick
Die IVDR umfasst einen weiteren Geltungsbereich als die bisherige Richtlinie und bringt in vielen Bereichen höhere und auch neue Anforderungen für die Unternehmen und Überwachungseinrichtungen mit sich:
- Es gibt ein neues Klassifizierungssystem – von einem listenbasierten System wird auf ein System mit den vier Risikoklassen A, B, C und D umgestellt. A umfasst Produkte mit geringem Risiko und D Produkte mit dem höchsten Risiko. Produkte ab der Klasse B oder höher erfordern zukünftig die Einbeziehung einer Benannten Stelle – dadurch erhöht sich die Anzahl an Produkten, die von einer Benannten Stelle überwacht werden müssen, deutlich.1)2)
- Die Anzahl möglicher Konformitätsbewertungsverfahren wurde auf drei Optionen verringert: Abhängig von der Produktklasse basiert die Konformitätsbewertung entweder ausschließlich auf der Technischen Dokumentation, einem zusätzlichen vollständigen Qualitätssicherungssystem oder einer Baumusterprüfung.3)
- Die Anforderungen an das Qualitätsmanagementsystem, die Technische Dokumentation und an die Überwachung nach dem Inverkehrbringen (Post-Market Surveillance) sind gestiegen.1)3)
- Die Konformitätsbewertung von Produkten der Klasse D erfordert die Einbindung von europäischen Referenzlaboren, um die Leistung des Produkts und die Einhaltung relevanter Vorgaben zu verifizieren.4)
- Mit der zeitlich nach den Risikoklassen gestaffelten Einführung einer neuen Produktidentifizierungsnummer (Unique Device Identification, UDI) ergeben sich darüber hinaus neue Kennzeichnungspflichten. Hierbei wird das Ziel einer besseren Nachverfolgbarkeit der Produkte verfolgt.1)5)
- Hersteller sind künftig verpflichtet, Daten über ihr Unternehmen, ihre Produkte sowie Informationen zu den UDIs in der EUDAMED-Datenbank zu hinterlegen, die als elektronisches Vigilanz- und Marktüberwachungssystem fungiert. Diese befindet sich weiterhin in der Umsetzungsphase. Bisher wurden die Module "Registierung von Wirtschaftsakteuren", "Einmalige Produktkennung (UDI) und Produktregistrierung" sowie "Benannte Stellen und Bescheinigungen" freigeschaltet (Stand April 2023).6)
- Jeder Hersteller muss intern mindestens eine „Verantwortliche Person“ benennen, deren Aufgaben über die des oder der Sicherheitsbeauftragten hinausgehen. Ebenso steigen die Anforderungen bezüglich der Qualifikation und Erfahrung der „Verantwortlichen Person“.7) Laut „MDCG 2019-7 Guidance on Article 15 of the Medical Device Regulation (MDR) and in vitro Diagnostic Device Regulation (IVDR) regarding a 'person responsible for regulatory compliance' (PRRC)“ kann diese Funktion in Kleinst- und Kleinunternehmen unter bestimmten Voraussetzungen auch extern besetzt werden.3)8)
- Große Veränderungen ergeben sich auch für die Zusammenarbeit zwischen Original Equipment Manufacturer (OEM) und Private Label Manufacturer (PLM). Nach derzeitigem Stand müsste der PLM vollen Zugriff auf die Technische Dokumentation des OEM erhalten, was Konfliktpotenzial im Bereich des geistigen Eigentums birgt.2)
Um Probleme und Fragen bei der Implementierung der MDR sowie der neuen Verordnung über In-vitro-Diagnostika (EU) 2017/746 (In-vitro Diagnostic Medical Devices Regulation, IVDR) zu identifizieren, wurde der Nationale Arbeitskreis zur Implementierung der neuen EU-Verordnungen über Medizinprodukte und In-vitro-Diagnostika (NAKI) vom Bundesgesundheitsministerium gegründet. Die Ergebnisse werden auf der Website veröffentlicht.
Fristen
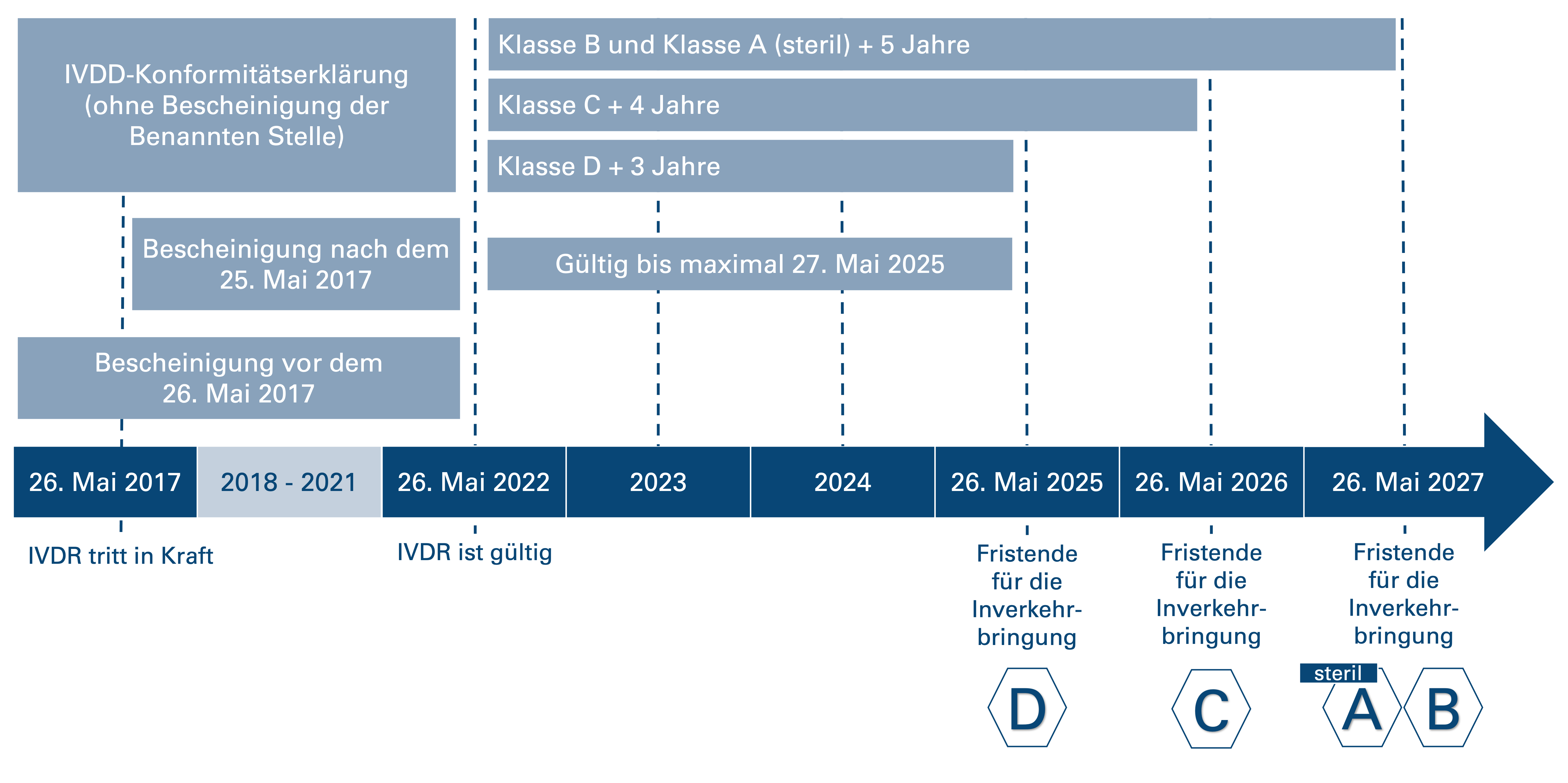
Aufgrund mangelnder Kapazitäten bei den Benannten Stellen hat die Europäische Kommission am 25. Januar 2022 eine Anpassungsverordnung (EU) 2022/112 veröffentlicht, durch die die Übergangsfristen für bestimmte In-vitro-Diagnostika angepasst wurden. Ziel dabei ist es, eine kontinuierliche Marktversorgung in der Europäischen Union sicherzustellen. Die verlängerten Übergangsfristen greifen allerdings nur, wenn bestimmte Bedingungen erfüllt sind. Zusätzlich zu den verlängerten Übergangsfristen für bestimmte Produkte wurde im Rahmen einer zusätzlichen Änderungsverordnung ((EU) 2023/607) im Jahr 2023 auch das Entfallen der Abverkaufsfristen beschlossen. Demnach ist die Bereitstellung auf dem Markt oder die Inbetriebnahme bestimmter Produkte auch nach Ablauf des Übergangszeitraums zulässig.
Bedingungen, an die die neuen Übergangsfristen geknüpft sind (Art. 1 Abs. 1 (EU) 2022/112):
- "Bescheinigungen, die von Benannten Stellen vor dem 25. Mai 2017 gemäß der Richtlinie 98/79/EG ausgestellt wurden, bleiben bis zu dem in der Bescheinigung angegebenen Zeitpunkt gültig, außer im Fall von Bescheinigungen gemäß Anhang VI der Richtlinie 98/79/EG, die spätestens am 27. Mai 2025 ihre Gültigkeit verlieren."
- "Prüfbescheinigungen, die von Benannten Stellen nach dem 25. Mai 2017 gemäß der Richtlinie 98/79/EG ausgestellt werden, verlieren spätestens am 27. Mai 2025 ihre Gültigkeit."
- "Produkte, für die das Konformitätsbewertungsverfahren gemäß 98/79/EG nicht die Mitwirkung einer [B]enannten Stelle erforderte, für die vor dem 26. Mai 2022 eine Konformitätserklärung gemäß der genannten Richtlinie ausgestellt wurde, und für die das Konformitätsbewertungsverfahren […] die Mitwirkung einer [B]enannten Stelle erfordert, dürfen bis zu [nachfolgend genannten] Zeitpunkten in Verkehr gebracht oder in Betrieb genommen werden."
Unter Berücksichtigung der oben genannten Bedingungen gelten nach den Anpassungsverordnungen (EU) 2022/112 und (EU) 2023/607 folgende Übergangszeiträume:
- Für In-vitro-Diagnostika der Klasse D endet die Frist der Inverkehrbringung am 26. Mai 2025.
- Für In-vitro-Diagnostika der Klasse C gilt der 26. Mai 2026 als Stichtag für die Inverkehrbringung.
- Für In-vitro-Diagnostika der Klasse B und sterile In-vitro-Diagnostika der Klasse A ist Geltungsbeginn der 27. Mai 2027.
- Für In-vitro-Diagnostika, die im Rahmen der Verordnung (EU) 2017/746 keine Mitwirkung einer Benannten Stelle erfordern, oder für Produkte, die neu Inverkehr gebracht werden, endete die Frist für die Inverkehrbringung am 26. Mai 2022.
Nachfolgende Grafik veranschaulicht die momentan geltenden Übergangsfristen nach den Anpassungsverordnungen (EU) 2022/112 und (EU) 2023/607:
 Großansicht:
© BIOPRO Baden-Württemberg GmbH | Stand 04.2023
Großansicht:
© BIOPRO Baden-Württemberg GmbH | Stand 04.2023
Benannte Stelle
Nicht nur die Produkte selbst, auch die Zertifizierungsstellen, die die Produkte der neuen Verordnung zertifizieren, müssen sich erneut als Benannte Stelle bewerben und nach einer Prüfung neu benannt werden. Derzeit gibt es in der EU 21 Benannte Stellen mit der Befugnis, nach den bisherigen EU-Richtlinien zertifizieren zu dürfen.9) Bisher haben 21 einen Antrag auf Neubenennung im Rahmen der IVDR gestellt9), zwölf Benannte Stellen wurden IVDR-konform neu benannt, davon vier in Deutschland (Stand Januar 2024).10) Der aktuelle Stand kann in der NANDO-Datenbank abgefragt werden.
Der Anteil überwachter Produkte und Hersteller, der unter der bisherigen IVD-Richtlinie 10 bis 15 Prozent betrugt, steigt mit Inkrafttreten der IVDR voraussichtlich auf 85 bis 90 Prozent.2) Zusätzlich zu der geringeren Anzahl Benannter Stellen, der höheren Anforderungen sowie der benötigten Neuzertifizierung der Produkte nach IVDR wird ein Engpass bei Benannten Stellen befürchtet.
Wir machen ausdrücklich darauf aufmerksam, dass unser Webangebot lediglich dem unverbindlichen Informationszweck dient. Alle angebotenen Informationen sind ohne Gewähr und erheben keinen Anspruch auf Vollständigkeit und Richtigkeit. Eine Haftung für die Angaben sowie für deren Rechtsverbindlichkeit wird nicht übernommen.